Ensayo clínico TALON: Eficacia y seguridad de brolacizumab en el tratamiento de la DMAE exudativa 26/11/2019
SI QUIERES PARTICIPAR EN UN ENSAYO CLÍNICO, ENVÍANOS TUS DATOS AQUÍ Y EVALUAREMOS SI ERES ELEGIBLE
Descripción
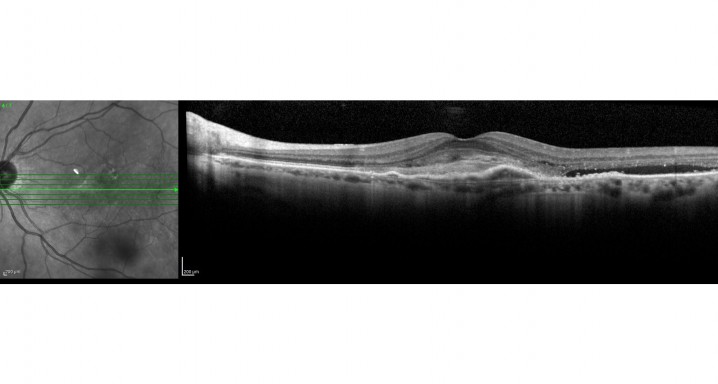
Estudio fase IIIb, multicéntrico, aleatorizado, con doble enmascaramiento de dos grupos, que evalúa la eficacia y la seguridad de brolacizumab 6mg comparado con aflibercept 2mg en una pauta de tratamiento hasta control en pacientes con degeneración macular asociada a la edad (DMAE) forma exudativa.
Criterios de inclusión principales
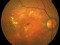
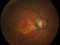
Pacientes de 50 años o mayores que presenten una neovascularización coroidea activa secundaria a DMAE y que no hayan recibido ningún tratamiento previo en el ojo de estudio.
La agudeza visual deberá estar comprendida entre 38 y 83 letras (equivalencia Snellen aproximada de 20/25 a 20/200).
Objetivos
Evaluar la eficacia y seguridad de brolacizumab en comparación con aflibercept en cuanto a los resultados de agudeza visual a las 28 y 32 semanas respecto de la basal, pero también en lo referente a la duración de los intervalos entre tratamientos.
Sobre el fármaco
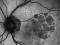
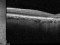
El factor de crecimiento endotelial vascular (VEFG), es una glicoproteína que tiene un papel trófico y proliferativo, promoviendo el crecimiento de nuevos vasos sanguíneos filtrantes y anormales en la retina en pacientes con DMAE exudativa.
Brolacizumab (RTH258) es un fragmento de anticuerpo de cadena sencilla (scFv) humanizado, que se encarga de bloquear la acción del VEFG-A, impidiendo que se una a sus receptores (VEFGR1 y VEFGR2) en la superficie de las células endoteliales, por lo que su función principal es la antiangiogénica. Brolacizumab está diseñado para uso oftálmico y se administra por inyección intravítrea.
Estudios previos han reflejado resultados que apoyan el inicio de un ensayo fase IIIb, para evaluar la seguridad y eficacia del brolacizumab en pacientes con DMAE neovascular, con el objetivo de prolongar el efecto terapéutico y permitir una mejor penetración en el tejido de la retina.
Duración
Este ensayo tiene una duración de dieciséis meses.
*Código Registro Institut: E08607500. Ensayo clínico Nº EudraCT 2019-000716-28. Ensayo clínico autorizado por la AEMPS y el CEIm Grupo Hospitalario Quironsalud en Barcelona.
SI QUIERES PARTICIPAR EN UN ENSAYO CLÍNICO, ENVIANOS TUS DATOS AQUÍ Y EVALUAREMOS SI ERES ELEGIBLE
Inyecciones intravítreasDMAE exudativa o húmeda