El Institut de la Màcula, primer centro acreditado en Europa para el ensayo médico CHROMA
02/02/2015 ·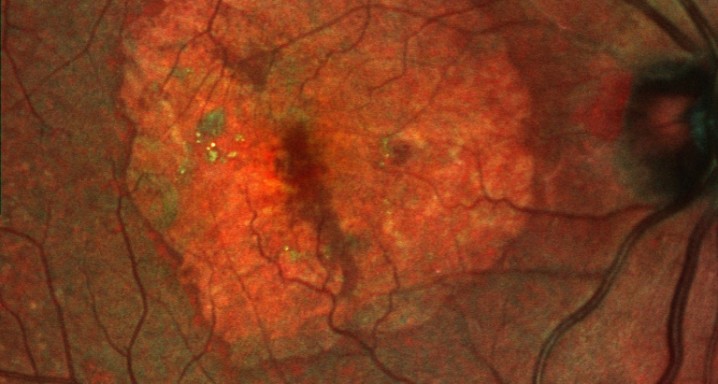
La Degeneración Macular Asociada a la Edad (DMAE) en su variante seca o atrófica es la primera causa de ceguera no-evitable en el mundo en personas mayores de 50 años y actualmente. Lampalizumab es la primera terapia que muestra eficacia significativa frenando la progresión de la DMAE, especialmente en pacientes con unas características genéticas determinadas. El estudio, liderado por la farmacéutica Roche y ya en fase de reclutamiento, convierte al Institut de la Màcula de Barcelona en un centro líder en ensayos clínicos.
El ensayo en fase III evalúa la eficacia y la seguridad de Lampalizumab administrado por inyecciones intravítreas en pacientes con atrofia geográfica (AG) secundaria a Degeneración Macular Asociada a la Edad (DMAE). Los estudios también determinarán si los pacientes con un determinado biomarcador –una mutación del factor I– se pueden beneficiar más del tratamiento con Lampalizumab.
Estos ensayos de fase III, denominados Chroma (GX29176) y Spectri (GX29185), son estudios aleatorizados de diseño idéntico, con doble enmascaramiento, que comparan una dosis de 10 mg de Lampalizumab administrada cada 4 o 6 semanas mediante inyección intravítrea con inyecciones simuladas. En cada estudio se reclutarán aproximadamente 936 pacientes (188 pacientes biomarcador positivo y 124 pacientes biomarcador negativo en cada uno de los grupos: tratamiento simulado, lampalizumab cada 4 semanas [c4s] y Lampalizumab cada 6 semanas [c6s] de cada estudio). Los estudios reclutarán pacientes de aproximadamente 300 centros de investigación de 24 países de todo el mundo. Los criterios de inclusión principales son similares a los del estudio MAHALO de fase II e incluyen la presencia de atrofia geográfica en ambos ojos sin antecedentes de DMAE neovascular (húmeda).
El objetivo principal de los estudios es demostrar una reducción en la tasa de progresión de la enfermedad AG. Este criterio de valoración de la eficacia, evaluado al cabo de un año (semana 48) se define como la media de la variación en el área de la lesión AG del ojo del estudio elegido desde el momento basal, medido por autofluorescencia del fondo de ojo (AFO), una técnica de imagen usada para proporcionar información sobre el tamaño y tipo de lesiones de AG en la mácula. Los objetivos secundarios de los estudios, planificados para evaluación a los dos años (96 semanas), se centran en la evaluación del impacto del tratamiento con Lampalizumab sobre la función visual de los pacientes. Si los estudios se completan con éxito, está previsto el seguimiento a largo plazo de los pacientes que completen Chroma y Spectri a través de un estudio de extensión abierto posterior.
Los resultados positivos de eficacia y seguridad del ensayo de Fase II previo, el estudio MAHALO, respaldan estos ensayos de Fase II. El criterio de valoración principal del estudio MAHALO mostraba una reducción del 20% en el mes 18 en la progresión de la lesión AG en pacientes tratados mensualmente con lampalizumab en comparación con el tratamiento simulado. Además, los datos de una subpoblación de pacientes con AG que recibían mensualmente lampalizumab y eran positivos para el biomarcador factor del complemento I (CFI), demostraron una reducción del 44% en la tasa de progresión de la enfermedad a los 18 meses.
“Lampalizumab es un hito en la lucha contra la DMAE atrófica. Por primera vez un medicamento ha demostrado eficacia en un estudio de Fase II para reducir la progresión del deterioro. La Fase III es una oportunidad para los pacientes que tienen la posibilidad de mejorar la degeneración. Los resultados de estos ensayos de Fase III pueden confirmar estos resultados prometedores”, señaló el Dr. Jordi Monés, uno de los principales investigadores de este ensayo Fase III.