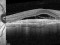
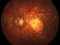
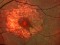
Ensayo clínico OPH2005: Eficacia y seguridad de Zimura en el tratamiento de la enfermedad de Stargardt 10/05/2018
Descripción
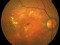
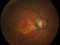
OPH2005 es un estudio en fase 2b randomizado, doble enmascarado para establecer la eficacia y la seguridad de Zimura™ en comparación con placebo en sujetos diagnosticados de enfermedad de Stargardt de herencia autosómica recesiva.
Los pacientes han sido asignados a los diferentes grupos de forma aleatoria.
Criterios de inclusión principales
Hombres y mujeres de entre 18 y 50 años con un mínimo de dos mutaciones patogénicas en el gen ABCA4 que han sido confirmadas por los laboratorios del estudio.
La agudeza visual de los pacientes deberá estar comprendida entre 20/20 y 20/200.
Objetivo
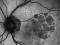
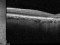
El objetivo del estudio evaluará la diferencia entre el cambio del área del defecto de la elipsoide medida con OCT.
Sobre el fármaco
Zimura está diseñado para inhibir la proteína del complemento C5.
Zimura se une e inhibe la escisión de C5 en C5a y C5b, lo que puede prevenir la formación del inflamasoma y la acumulación del complejo de ataque a membrana (MAC), lo que prevendría la muerte celular.
*Código Registro Institut: E08607500. Ensayo clínico Nº EudraCT 2017-004783-35 autorizado por la AEMPS y el CEIm Grupo Hospitalario Quironsalud en Barcelona.
PREGUNTAS FRECUENTES
¿Quién puede participar en este ensayo clínicos?
Este ensayo clínico está dirigido únicamente a pacientes diagnosticados de enfermedad de Stargardt con al menos dos mutaciones patogénicas en el gen ABCA4 cuya visión esté comprendida entre 20/20 (100%) y 20/200 (10%) y no presente ninguna otra enfermedad ocular.
¿Qué beneficios y/o riesgos conlleva la participación en un ensayo?
Participar en un ensayo clínico ofrece una serie de ventajas para el paciente: tiene la oportunidad de acceder a los tratamientos más innovadores, con una atención personalizada y de vanguardia por parte de expertos médicos. Además, esta es, por el momento, la única vía de acceso a nuevos fármacos aún no disponibles para la población general.
Los ensayos clínicos se realizan según principios éticos y científicos estrictos. En el Institut aplicamos las normas y políticas nacionales e internacionales para proteger los derechos, la seguridad y el bienestar de las personas que participan en ellos.
Los riesgos por la participación en un ensayo clínico se pueden derivar de la vía de administración del medicamento por un lado y de la medicación por otro. Los riesgos del primero son conocidos y generalmente bajos; los derivados de la medicación son sólo parcialmente conocidos, pero habitualmente leves y delimitados al ojo. En cualquier caso, el paciente será informado por el investigador de los posibles efectos adversos y molestias derivados de su participación en el estudio, que pueden variar de un paciente a otro.
¿Qué coste tiene para el paciente?
Los pacientes seleccionados no tienen que costearse el tratamiento, por lo que este es totalmente gratuito.
¿Qué duración tiene este ensayo clínico?
La duración de este ensayo clínico es de 18 meses.
¿Cuántas veces tendré que desplazarme al Institut de la Màcula?
Una vez seleccionado para formar parte de este ensayo clínico el paciente tendrá que acudir obligatoriamente a las visitas pautadas por el protocolo de estudio.
Estas visitas tendrán una periodicidad quincenal durante tres meses y mensual des del tercer mes hasta final del estudio.
Inyecciones intravítreasEnfermedad de StargardtAutor
Dr. Jordi Monés, M.D., Ph.D.
Número de Colegiado COMB: 22.838
Director
Doctor en Medicina y Cirugía
Especialista en Oftalmología
Especialista en Retina, Mácula y Vítreo