IONIS: seguridad y eficacia de dosis múltiples de IONIS-FB-LRX 04/12/2022
 Reclutando
Reclutando
Descripción
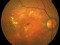
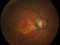
Es un estudio de fase 2, aleatorizado controlado con placebo y doble máscara para evaluar la seguridad y eficacia de dosis múltiples de IONIS-FB-LRX, un inhibidor antisentido del Complemento Factor B, en pacientes con atrofia geográfica secundaria a la degeneración macular asociada a la edad (DMAE).
Objetivos
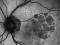
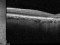
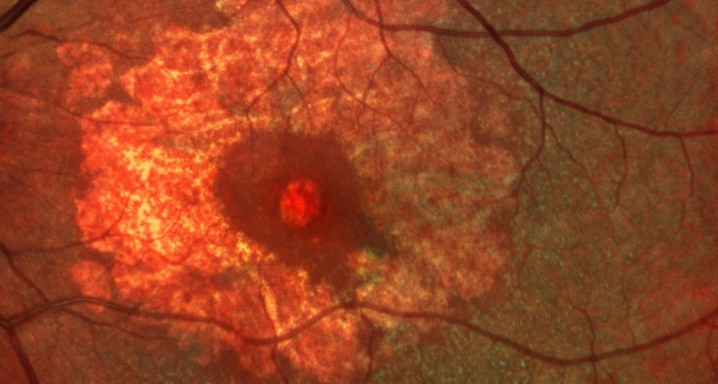
- Evaluar el efecto del ISIS 696844 sobre la tasa de cambio del área de GA secundaria a DMAE medida por autofluorescencia de fondo (FAF)
- Evaluar el efecto del ISIS 696844 sobre los niveles plasmáticos de Factor B y la actividad sérica AH50 en pacientes con DMAE
- Evaluar el efecto del ISIS 696844 en la reducción lenta de la agudeza visual de baja luminancia
Fármaco
ISIS 696844 (40,70, 100 mg) o placebo, por vía subcutánea (SC). Injección en las semanas 1, 3, 5 y cada 4 semanas hasta la semana 45.
Criterios de inclusión
- Hombres o mujeres con edad mínima de 50 años en el momento del consentimiento informado.
- Vacunación contra Neisseria meningitidis (conjugado quatrivalente y serogrupo B) y Streptococcus pneumoniae al menos 2 semanas antes de la primera dosis del producto en estudio.
- Diagnóstico de DMAE unilateral o bilateral confirmado por el centro.
- GA bien delimitada por DMAE de área total 1,7-17 mm2.
Duración
La duración total de la participación del paciente será de aproximadamente 18 meses (periodo de cribado aproximado de 3 meses, periodo de tratamiento, 12 meses, más 3 meses posteriores al tratamiento).
Es posible que los pacientes deban asistir a visitas no programados para controlar los efectos adversos o anormales resultantes durante la investigación. La frecuencia de seguimiento adicional la determinará el controlador médico, en consulta con el investigador.
DMAE seca o atrófica